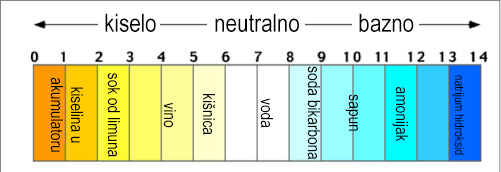
Koliki je pH vode?
pH (električni potencijal za vodonikove jone, tj. mera privlačenja protona) predstavlja bezdimenzionalnu veličinu koja se definiše kao negativan logaritam koncentracije slobodnih protona (tj. vodoničnih jona) u datom rastvoru.
pH čiste vode (a savršeno čista voda verovatno ne postoji nigde u prirodi) je jednak 7, što znači da svim slobodnim protonima odgovara jednak broj hidroksilnih grupa (-OH), što rezultuje u tzv. neutralnom rastvoru. Kao što rastvori baza (…-OH) imaju višak slobodnih OH grupa nego protona (što rezultuje u pH većem od 7), tako i rastvori kiselina imaju u sebi višak slobodnih protona nego OH grupa, što opet rezultuje u pH manjem od 7. Drugim rečima, kisele rastvore karakteriše pH manji od 7, dok bazni (tzv. alkalni) rastvori poseduju pH veći od 7.
Međutim, ukoliko ste nekada izmerili pH destilovane vode iz laboratorije, možda ste se začudili kada ste primetili da njen pH oko 5,5. Razlog ovoj pojavi je u tome što destilovana voda (prečišćena voda koja se dobija putem isparavanja i kondenzacije vode iz rastvora) tokom procesa destilacije gubi mnoštvo jonskih molekula koji su pružali izvestan puferski efekat (puferi su smeše soli i kiseline koje imaju sposobnost da ne dozvoljavaju veće i nagle promene pH), pa u kontaktu sa vazduhom, dolazi do rastvaranja ugljen dioksida u vodi, što zapravo dovodi do nastanka male količine ugljene kiseline, a što u vodi bez mineralnih pufera, snižava pH čak do oko 5,5. Ipak, voda koju pijemo je prepuna, pa ponekad skoro i zasićena raznim mineralima, kao što su kalcijum, magnezijum (koji definišu “tvrdoću” vode), silikati, natrijum, kalijum i hlor koji se najčešće koristi za dezinfekciju vode. Stoga je i njen pH takođe malo različit, ali i dalje veoma blizak 7.